COVID-19 Interleuchina 6 – Recettore degli Androgeni e organo adiposo: quali possibili target da questa associazione?

Alexander Bertuccioli & Daniele Balducci
La recente pandemia da SARS-CoV-2 ha portato la stragrande maggioranza dei sanitari a impegnarsi sul campo e/o in laboratorio per cercare di fornire contributi utili alla sua risoluzione, recentemente collaborando con i colleghi Daniele Balducci, Marco Neri e Alfredo Bressan abbiamo cercato di fornire il nostro piccolo e modesto contributo nelle sedi appropriate al dibattito scientifico realizzando un commetary che analizza alla luce dei dati disponibili al momento della stesura, quali correlazioni possono sussistere tra COVID-19, IL-6, recettore degli androgeni e organo adiposo. Viste le numerose richieste di diversi miei studenti e collaboratori ho deciso insieme al collega Balducci di realizzare questa versione riassunta e semplificata in italiano, l’articolo rimane tecnico in quanto riservato agli addetti ai lavori, mi scuso in anticipo con chi segue i post divulgativi.
INTRODUZIONE
Nel dicembre del 2019 una serie di polmoniti di eziologia sconosciuta sono state segnalate nella città di Wuhan, (regione di Hubei, Cina) con manifestazioni cliniche suggestive di affezione di natura virale. L’analisi di campioni proveniente dal tratto respiratorio inferiore dei soggetti affetti ha permesso l’identificazione di un nuovo coronavirus, inizialmente chiamato 2019-nCoV e successivamente rinominato SARS-CoV-2. Il suo sviluppo si è dimostrato purtroppo molto rapido, evolvendo da epidemia con interessamento locale, a focolai epidemici multipli per arrivare a vera e propria pandemia. Il SARS-CoV-2 è un nuovo coronavirus che appartiene al cluster dei beta-coronavirus, responsabile della terza malattia attualmente conosciuta a trasmissione zoonotica da coronavirus dopo la SARS e la MERS. Secondo i dati attualmente disponibili i primi casi sarebbero emersi nella zona circostante il wet market di Wuhan, in Cina, da cui la malattia si sarebbe diffusa rapidamente prima a livello locale e successivamente a livello globale grazie ad una efficiente dinamica di trasmissione interpersonale. La patologia si presenta con uno spettro clinico molto ampio che include casi di infezione asintomatica, lieve infezione delle alte vie respiratorie, polmonite severa, sindrome da distress respiratorio severa (ARDS) e morte. I fattori di rischio attualmente accertati sono età avanzata, alto Sequential Organ Failure Assessment score (SOFA score) e presenza di comorbidità croniche. Questi fattori non permettono però di spiegare la presenza di disparità tra i generi nello sviluppo di malattia severa e la presenza, seppur limitata, di decessi in giovani pazienti precedentemente sani a seguito di infezione da SARS-CoV-2. Un recente studio ha mostrato, tramite un’analisi di variabili indipendentemente associate con malattia da COVID-19 severa, che il genere maschile è stato il più importante fattore di rischio indipendente con un odd-ratio (OR) di 3,60 [95% confidence interval (CI) 1.75–7.75] rispetto all’ipertensione, OR 2,71 [95% CI 1.32–5.59], ed un’età maggiore di 50 anni, OR 1,06 [95% CI 1.03–1.08]. Diversi altri studi hanno mostrato una significativa differenza nell’incidenza di casi severi di malattia tra i maschi e le femmine. Secondo una meta-analisi condotta da Xiyi Wei et al14 su 77932 pazienti, di cui 41510 (53%) maschi, questi ultimi hanno mostrato un importante aumento di rischio di sviluppare malattie severa rispetto alle donne (OR = 1.63; 95% Cl = 1.28-2.06) ed una significativa maggiore mortalità (OR = 1.71; 95% CI = 1.51-1.93). Inoltre su 1099 casi riportati in un altro studio il 58% erano maschi, e tra i 67 pazienti con sintomi severi che hanno richiesto la terapia intensiva, la ventilazione non invasiva o che sono deceduti il 67% erano di sesso maschile. Allo stesso modo anche l’obesità sembra essere un importante fattore di rischio, che potrebbe in parte spiegare il più alto tasso di mortalità registrato in Italia e negli USA rispetto alla Cina. Uno studio retrospettivo pubblicato recentemente ha mostrato che la proporzione dei pazienti che richiedevano ventilazione meccanica invasiva (IMV) aumentava con l’aumentare del BMI (p<0.01, Chi square test per il trend) e che il ricorso ad IMV era maggiormente associato con il genere maschile (p<0.05) indipendentemente dall’età, diabete e l’ipertensione.
MECCANISMI DI INTERAZIONE VIRUS-OSPITE E DINAMICHE DI INFEZIONE
Dopo una prima fase di replicazione virale e citolisi, caratterizzata da sintomi simil-influenzali, è stata documentata una seconda fase caratterizzata dal peggioramento dei sintomi respiratori che, in alcuni pazienti, tipicamente tra i 5 e i 10 giorni dall’inizio della sintomatologia, può portare allo sviluppo della polmonite e dell’ARDS. Dal punto di vista meccanicistico SARS-CoV-2 si lega all’enzima ACE2 tramite una proteina di superficie definita proteina S (o spike protein) di 180 kDa in grado di legarsi mediante uno specifico dominio di legame recettoriale (RBD) dopo il priming della proteina S per mezzo della serin-proteasi TMPRSS2, senza la quale il virus non riesce ad entrare. Tramite questo legame il virus riesce ad invadere le cellule dell’epitelio orofaringeo. Tuttavia ACE2 non rappresenta soltanto la porta di ingresso per il virus ma potrebbe essere coinvolto nella patogenesi della mattia in quanto è nota una sua implicazione nello sviluppo dell’ARDS. L’enzima ACE2 agisce come controregolatore alla formazione di angiotensina II, peptide dagli effetti pro-ipertensivi prodotta dall’enzima ACE (target dei farmaci antiipertensivi ace-inibitori). ACE2 catalizza la conversione di angiotensina ad angiotensina(1-9) sostanza secondo alcuni autori in grado di agire come inibitore di ACE, o dell’angiotensina II in angiotensina(1-7) identificata come agente ipotensivizzante. L’angiotensina II, oltre alle caratteristiche pro-ipertensive, può indurre l’attivazione di varie cellule del sistema immunitario come cellule T, cellule endoteliali, fibroblasti, macrofagi e monociti, e la produzione di citochine pro-infiammatorie come l’IL-6 e il TNF-alfa. Il legame tra il virus e ACE2 può dunque spiegare molti aspetti della patogenesi del covid-19. Quando il virus interagisce con ACE2 causa infatti una sua down-regolazione togliendo il freno che questo conferiva all’angiotensina II, inducendo l’attivazione locale di cellule immunitarie, l’aumento dell’infiammazione e la morte cellulare. A livello polmonare ACE2 è espresso dalle cellule alveolari di tipo 2 (AT2) che, sebbene costituiscano soltanto il 5% delle cellule alveolari, sono responsabili della produzione del surfattante, essenziale per mantenere l’elasticità polmonare, e rappresentano le cellule progenitrici delle cellule AT1, responsabili degli scambi gassosi. La riduzione delle cellule AT2 e il conseguente deficit di surfattante è stato precedentemente associato ad una riparazione incompleta degli alveoli danneggiati nell’epitelio polmonare e all’obliterazione fibrotica , contribuendo pertanto spiegare lo sviluppo del danno polmonare da COVID-19. Degno di nota il fatto che mediante indagine del trascrittomiche è stato possibile evidenziare la presenza di ACE2 a livello degli spermatogoni, delle cellule di Leydig e Sertoli, facendo del testicolo umano un altro potenziale targhet virale. Gli spermatogoni rilevati positivi all’espressione di ACE2 sembrano esprimere un numero più elevato di geni correlati alla riproduzione e alla trasmissione virale e un minor numero di geni correlati alla spermatogenesi rispetto a spermatogoni ACE2 negativi. Le cellule di Leydig e Sertoli positive all’ACE2 esprimono un più alto tenore geni coinvolti nella giunzione cellula-cellula e nei processi immunitari e un minor tenore di geni associati all’attività mitocondriale e alla riproduzione, rispetto alle controparti ACE2 negative. Questi risultati suggeriscono che anche il testicolo è un organo potenzialmente ad alto rischio e ad alta vulnerabilità per l’infezione di SARS-CoV-2, ulteriore fattore da tenere in considerazione nell’analisi della maggiore mortalità nel genere maschile.
IL RUOLO AGGRAVANTE DELL’INFIAMMAZIONE
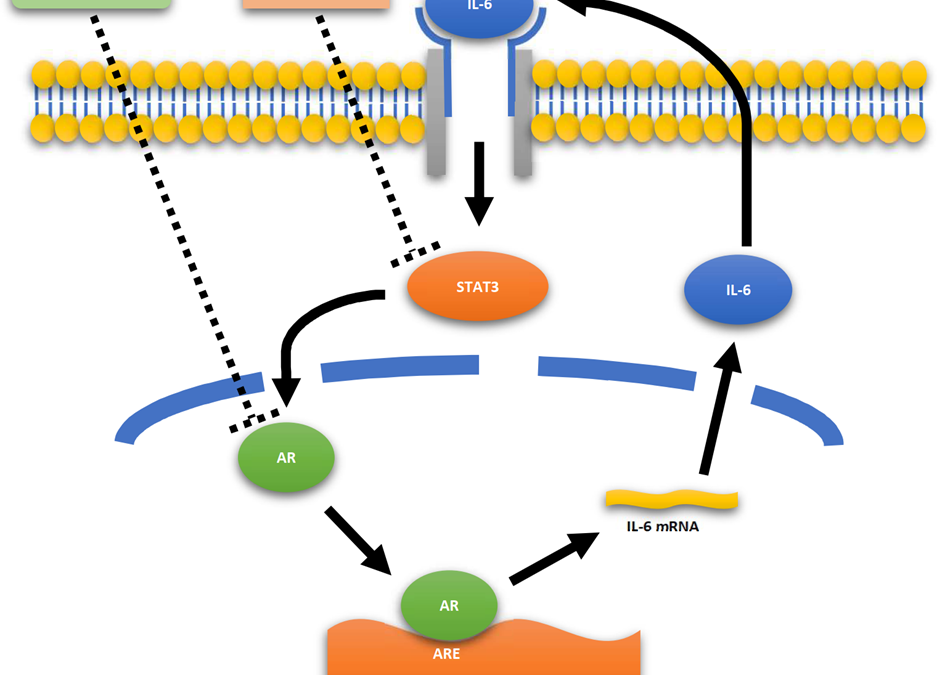
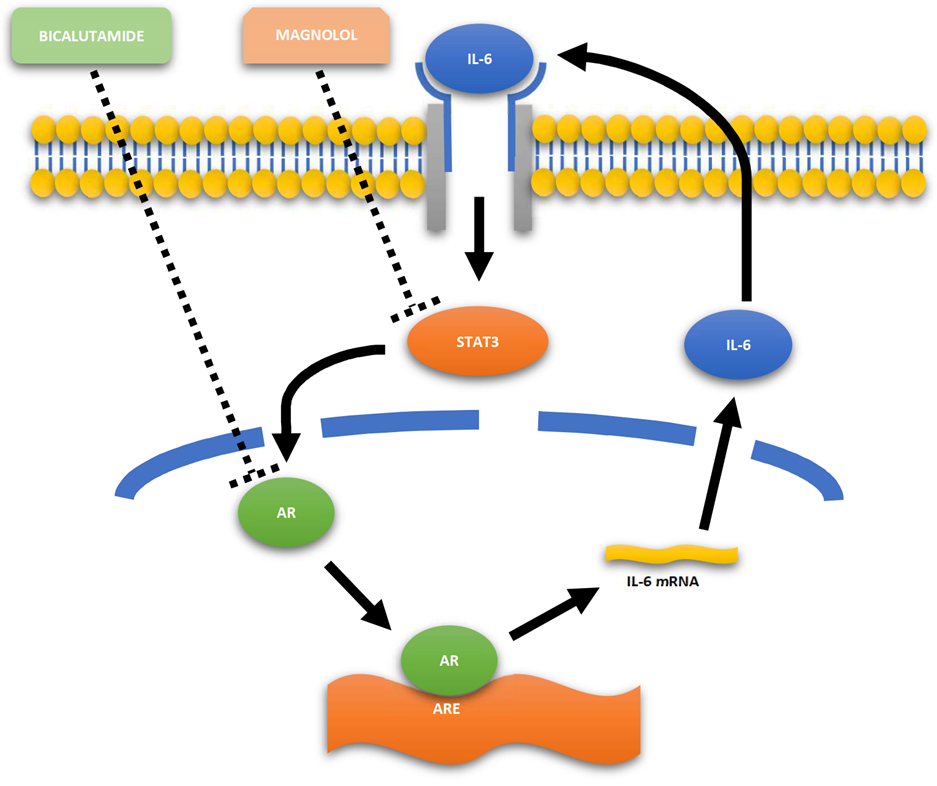
L’infiammazione polmonare causata dal SARS-CoV-2, in maniera simile a quella provocata dalla SARS, è stata comparata all’attivazione immunitaria non controllata osservata in corso di linfoistiocitosi emofagocitica (HLH) o nella sindrome da rilascio citochinico osservata in alcuni trattamenti antitumorali e in quadri caratteristici di sepsi. Infatti, in casi severi di infezione da SARS-CoV-2 possono essere riscontrati segni di significativa attivazione del sistema immunitario come alti livelli di PCR, ferritina e IL-6. In particolare livelli sierici di citochine pro-infiammatorie come il TNF-alfa, IL-1 e IL-6 sono stati rilevati nei pazienti con malattia da SARS-CoV-2 severa rispetto ai casi non severi e l’exitus nei pazienti con ARDS è stata collegata ad un aumento considerevole di IL-6 e IL-1 sostenuto nel tempo. Dati preliminari, suggeriscono che la severità dell’infezione da SARS-CoV-2 può essere associata ad una riduzione della produzione di INF-gamma da parte delle cellule T CD4+ suggerendo che nei pazienti con malattia severa può essere venuta meno una prima linea di difesa contro il virus. Analogamente a quanto accade nella HLH, la perdita della difesa antivirale di prima linea può essere alla base di una seconda ondata di attivazione immunitaria più aggressiva nei confronti del tessuto che comprende la produzione abnorme di IL-6 che culmina nella produzione secondaria di una tempesta citochinica. Trials preliminari mostrano che bloccare la cascata di IL-6 intervenendo sul recettore IL-6R con l’ anticorpo monoclonale umanizzato Tocilizumab possa avere in alcuni casi una certa efficacia. Tuttavia bisogna considerare che ancora non è stato perfettamente chiarito se elevati livelli di IL-6 siano dannosi solamente nella polmonite da SARS-CoV-2. In modelli sperimentali l’IL-6 può infatti sia sopprimere che facilitare la replicazione virale, sono quindi necessari ulteriori studi relativi al suo ruolo nell’infezione da SARS-CoV-2 per dirimere la questione. In questo contesto il timing di una eventuale terapia anti-IL6R risulta fondamentale, perché se eseguita troppo precocemente potrebbe, almeno in linea teorica, ritardare la clearance virale. Come visto precedentemente, i pazienti di sesso maschile sembrano avere un rischio più elevato di sviluppare una patologia severa da covid-19 rispetto a quelli di sesso femminile. Il meccanismo che sta alla base della differenza tra i generi non è chiaro. Alcuni studi hanno mostrato che il differente outcome tra i generi possa essere correlato ad una possibile funzione protettiva esercitata dagli estrogeni. Xiyi Wei et al hanno evidenziato una più alta percentuale di ACE2 espresso nelle cellule polmonari AT2 e una più alta espressione del recettore per IL-6 IL-6ST (denominato anche come gp130, IL6ST, IL6-beta o CD130), nella popolazione maschile rispetto a quella femminile. Questo alla luce dei meccanismi patogenetici precedentemente descritti, potrebbe spiegare la maggiore suscettibilità della popolazione maschile ad una infezione di carattere severo. Un ulteriore ruolo che rimane da considerare è quello esercitato dal recettore solubile degli androgeni (AR), che quando attivato può esercitare un ruolo nel regolare in maniera positiva l’espressione di ACE2. Gli androgeni hanno già mostrato in lavori precedenti di svolgere un ruolo molto importante nella modulazione dell’infiammazione in diversi organi. AR in particolare mostra un possibile ruolo nello sviluppo della tempesta citochinica; in modelli oncologici è stato mostrato che legando direttamente il gene promotore di IL-6, AR può aumentare la trascrizione di IL-6, che a sua volta attivare l’espressione del gene per AR creando un circuito che di alimentazione e amplificazione reciproco mediato da STAT-3. Considerata dunque la più alta espressione di androgeni nei soggetti di sesso maschile rispetto ai soggetti di sesso femminile, AR può essere considerato un altro importante co-fattore nello sviluppo della malattia severa. Come illustrato precedentemente la serin-proteasi 2 transmembrana (TMPRSS2) gioca un ruolo fondamentale nell’entrata del virus nelle cellule. E’ quindi importante sottolineare anche che l’attività di AR è richiesta per la trascrizione del gene di TMPRSS2 in quanto nessun altro elemento regolatorio del suo promotore è stato descritto negli umani fino ad ora. Inoltre l’espressione dell’mRNA di TMPRSS2 sembra essere regolato dalla presenza di androgeni nelle cellule prostatiche, anche AR si mostra responsabile dell’up-regulation dell’mRNA di TMPRSS2. Il gene di TMPRSS2 è principalmente espresso nella cellula dell’adulto, ma è espresso anche in altri tessuti come colon, piccolo intestino, pancreas, reni, polmoni e fegato. Nel caso tutti questi dati venissero confermati potrebbero mostrarsi interessanti possibilità di add-on therapy realizzando interventi con molecole in grado di inibire l’attivazione di AR come la bicalutamide, molecola in grado di legarsi ad AR senza attivarne l’espressione genica e inibendo in questo modo lo stimolo androgenico oppure come il Magnololo, molecola in grado di regolare la fosforilazione di STAT3 con un meccanismo Jak-indipendente, sopprimendo gli effetti dell’IL-6 senza compromettere l’attivazione di Jak.
IL POSSIBILE RUOLO DELL’ORGANO ADIPOSO
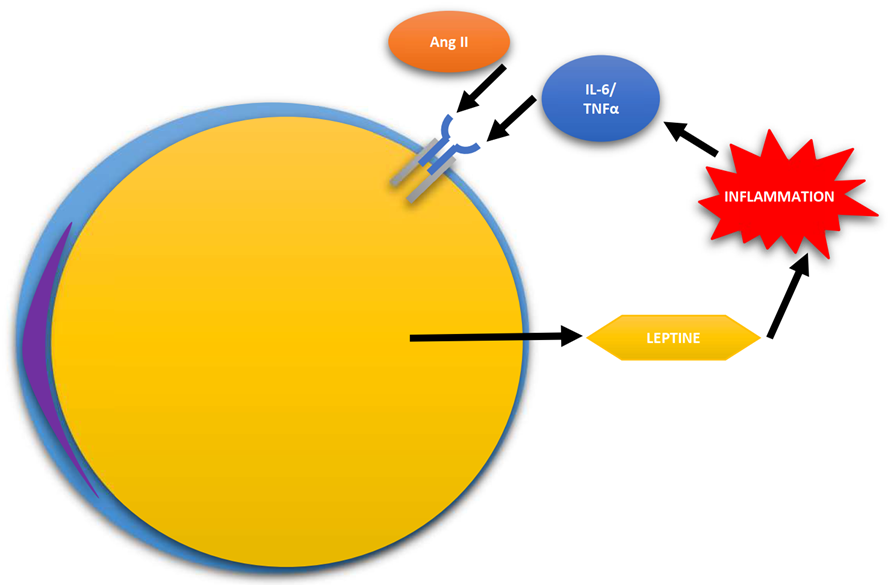
L’obesità è stata correlata tra i fattori connessi a gravi manifestazioni cliniche e a una maggiore mortalità dovuta da infezione da SARS-CoV-2. Una recente review realizzata da Guzik et.al. analizzando il ruolo delle adipocitochine come potenziali elementi di connessione tra infiammazione e funzione vascolare analizza alla luce dei dati presenti in letteratura le diverse connessioni tra queste molecole e diversi elementi implicati nella risposta infiammatoria con una potenziale rilevanza anche nell’infezione da SARS-CoV-2. L’obesità è una condizione caratterizzata da una condizione di infiammazione sub-clinica generalizzata, con da elevati livelli di proteina C reattiva e produzione di diverse citochine pro-infiammatorie dovuta all’azione dis-regolata di alcuni elementi cellulari del sistema immunitario. Il tessuto adiposo viene ormai da tempo ritenuto un vero e proprio “organo” con funzione endocrina in grado di esercitare effetti anche sul sistema immunitario e sulla cascata infiammatoria grazie alla presenza di adipocitochine. Le adipocitochine vengono prodotte a livello dell’organo adiposo, quelle maggiormente rappresentate sono Leptina, Resistina e Adiponectina. Esiste una profonda connessione tra adipociti e citochine pro-infiammatorie, che oltre ad essere prodotte a livello di cellule del sistema immunitario infiltrate nell’organo adiposo, vengono prodotte anche a livello adipocitario. Gli adipociti si dimostrano infatti in grado di produrre TNF-α e IL-6, creando un collegamento tra obesità e dinamiche infiammatorie. Quasi il 30% del totale di IL-6 presente negli individui obesi può essere di origine adipocitaria, questa produzione di chemochine inoltre potrebbe rivelarsi responsabile dell’infiltrazione macrofagica nell’organo adiposo creando potenzialmente un circuito in grado di autoalimentarsi. La leptina è una proteina espressa primariamente a livello adipocitario e secondariamente a livello di altri siti tra cui quello gastrico, vascolare, placentare, ovarico, muscolare ed epatico. Una dei primari ruoli della leptina è quello di agire nel controllo dell’appetito, in quello che viene definito asse cervello-intestino, fornendo in condizioni fisiologiche un segnale di sazietà a livello ipotalamico. I livelli circolanti di leptina si dimostrano direttamente proporzionali ai livelli di massa grassa, aumentando o decrescendo contestualmente alle sue variazioni. Tra i diversi agonisti in grado di favorire il rilascio adipocitario di leptina sono riscontrabili diverse citochine tra cui TNF-α, angiotensina II. La leptina ha mostrato di avere una vasta gamma di effetti in diversi distretti dell’organismo con particolare interessamento dell’apparato cardiovascolare e del sistema immunitario, il suo ruolo è inoltre stato correlato ad alcuni quadri oncologici. La leptina si dimostra in grado di esercitare attività pro-infiammatorie a cagione delle sue analogie strutturali con citochine classiche come IL-6, GM-CSF o IL-12, inoltre diverse cellule immunitarie tra cui leucociti polimorfonucleati, monociti, macrofagi e linfociti esprimono recettori per la leptina, costituendo un importante elemento di connessione tra lo stato nutrizionale e quello immunitario, con capacità di attivazione di cellule del sistema immunitario tra cui principalmente monociti, linfociti T e neutrofili. Degno di nota il fatto che a livello delle cellule endoteliali delle vene ombelicali umane è stato possibile, oltre al recettore per la leptina è stata evidenziata anche la fosforilazione della tirosina indotta dalla leptina e l’attivazione del fattore di trascrizione Stat3, questo potrebbe sovrapporsi se confermato in altre linee cellulari al meccanismo evidenziato per l’attivazione di AR da parte dell’IL-6, dimostrandosi un ulteriore potenziale elemento in grado di intervenire nel accensione e mantenimento del circuito auto alimentato in precedenza descritto. Tra le sostanze in grado di modulare l’espressione di leptina e resistina studi su diversi modelli sperimentali hanno identificato la curcumina e la silibina estratte rispettivamente da Curcuma longa e Silybum marianum, effetti simili sono stati riscontrati per molecole isolate da Capsicum anuum, Cinnamomum zeylanicum, Eugenia caryophyllus, Piper nigrum e Zingiber officinalis con meccanismi non ancora completamente chiariti.
CONCLUSIONI
Esistono sicuramente numerosi fattori capaci di giustificare una prevalenza maggiore di malattia e complicanze nel sesso maschile correlati per esempio a fattori fisiologici come una minor protezione ormono-guidata verso le complicanze cardiovascolari , alla capacità del virus di infettare il testicolo o a fattori comportamentali come la maggior propensione all’abitudine tabagica, già precedentemente associata ad un peggiore outcome della malattia. Quanto proposto potrebbe tuttavia contribuire a spiegare la più elevata severità e mortalità correlata a infezione da SARS-CoV-2 nei soggetti di sesso maschile, in particolare obesi, ipotizzando un ruolo centrale di AR come importante fattore precipitante con il potenziale ulteriore contributo fornito dagli alti livelli di leptina caratteristici del soggetto obeso. Se queste ipotesi venissero confermate una terapia anti-AR con Bicalutamide e/o Magnololo potrebbe essere proposta come nuova strategia in add-on per il trattamento dell’infezione da SARS-CoV-2 nei soggetti di sesso maschile. Eventualmente integrata con le molecole descritte in grado di modulare l’espressione di leptina nel soggetto obeso. Ulteriori studi sono tuttavia assolutamente necessari per valutare questa ipotesi e potrebbero rilevarsi utili non solo per trovare nuove strategie terapeutiche ma anche per stratificare meglio il rischio di malattia severa da SARS-CoV-2 in base alla suscettibilità e alle caratteristiche dell’ospite.
BIBLIOGRAFIA
Bertuccioli A, Balducci D, Neri M. Bressan A. COVID-19, interleukin-6,androgen receptor and the adipose organ: what are the possible targets of this association? Nutrafoods (2020) 2:176-185 DOI 10.17470/NF-020-0024
https://www.nutrafoods.eu/wp-content/uploads/2020/08/doi_10.17470_nf-020-0024.pdf