BIFIDOBACTERIUM: IL COME, IL QUANDO E IL PERCHÉ DI UN GENERE BATTERICO CHE SI TRASMETTE DA MADRE A FIGLIO

Francesco Di Pierro
Direttore Scientifico Velleja Research & MyMicrobiota
Per gentile concessione dalla pubblicazione originale: edit Symposia nr. 1 – 2020 – Editeam, Cento
PREMESSA
Nell’ ormai lontano settembre 2002, il New England Journal of Medicine pubblicava un grafico di quelli che passano alla storia (Fig. 1). Per la prima volta veniva messo in chiaro l’andamento diametralmente opposto che effettivamente veniva osservato tra l’incidenza di alcune tra le principali patologie infettive, in netto decremento, e alcune patologie del sistema immunitario, autoimmunità ed atopia su tutte, in evidente aumento (1).
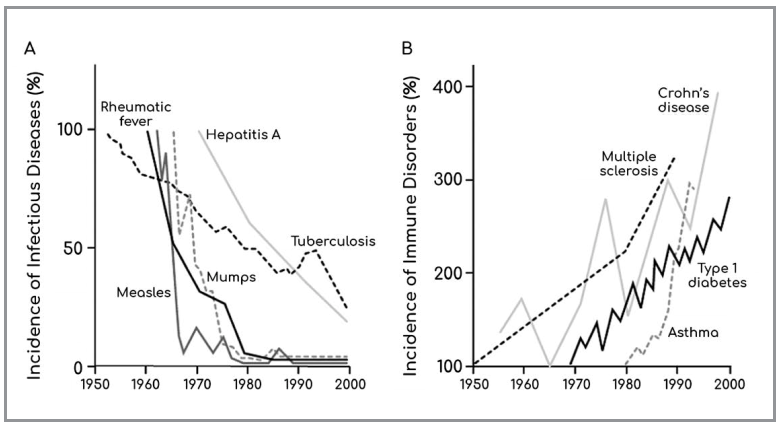
partire dagli anni ‘50 del XIX secolo (Bach JF. The Effect of Infections on Susceptibi-
lity to Autoimmune and Allergic Diseases. N Engl J Med 2002; 347 (12): 911-20).
Il dato, assolutamente netto e incontestabile, risultava apprezzabile a partire dagli anni ‘50. Questa inversione nelle incidenze percentuali, coincideva, almeno temporalmente, con l’inizio del massiccio uso di antibiotici e con un sempre maggior ricorso al taglio cesareo e all’allattamento artificiale. Oggi noi ragionevolmente consideriamo queste tre diverse condizioni, almeno nel loro insieme, in grado di contribuire a ridurre il “contatto” tra il mondo dei batteri e quello del suo ospite uomo e non è insensato pensare che questo mancato contatto abbia potuto, almeno in parte, contribuire all’attuale “epidemia” di disordini immunitari. Dal momento che l’aumentata incidenza di patologie immunitarie riguarda sicuramente anche l’ambito pediatrico, e in considerazione del fatto che sia l’uso di antibiotici quanto le modalità di parto e di allattamento riguardano sicuramente la sfera pediatrica, ci si potrebbe interrogare su quale tipo di dismicrobismo, in senso lato, potrebbe essere, almeno in parte, ricondotto, come possibile evento causativo, ai dati osservati. Secondo molti Autori,
questo dismicrobismo potrebbe essere ricondotto al crollo della presenza di bifidobatteri nei primi mesi di vita di un individuo.
IL GENERE BIFIDOBACTERIUM E LA SUA RILEVANZA NEL NEONATO
I bifidobatteri sono procarioti Gram-positivi, primariamente saccarolitici e capaci di metabolizzare con grande efficienza le fibre prebiotiche, quali ad esempio inulina, GOS e FOS. Alcune specie all’interno del genere Bifidobacterium, come ad esempio i B. longum infantis, i B. bifidum e i B. breve, risulterebbero geneticamente predisposte anche a metabolizzare, con differente grado di efficienza, i glicani della mucina e gli oligosaccaridi del latte materno (2). I bifidobatteri sono fisiologicamente abbondanti solo nei bambini piccoli, soprattutto nel loro primo anno di vita, e dovrebbero essere presenti, ma questo non avviene sempre, nelle donne incinte, dalle quali verrebbero ereditati durante il parto e l’allattamento. La loro assenza nel bambino sembrerebbe predisporre ad atopia (3) e ad obesità (4). I bifidobatteri vengono sicuramente distrutti dagli antibiotici quando somministrati nella prima infanzia (5) e sono assenti nei bambini partoriti via taglio cesareo, non allattati al seno o nati da madri che ne erano prive (6). Nell’intestino neonatale, la loro assenza favorisce la crescita dei batteri, Gram-negativi, appartenenti al phylum dei Proteobacteria, con conseguente incremento del rischio infettivo e dei fenomeni di permeazione intestinale di LPS (Fig. 2). Quest’ultimo fenomeno sembrerebbe determinare l’aumento dei fenomeni infiammatori TNF-mediati (7) ai quali potrebbero essere ricondotti tanto il rischio di obesità quanto quello di asma (8). La stretta connessione esistente tra parto cesareo ed assenza di bifidobatteri e tra assenza di bifidobatteri e predisposizione ad asma e obesità, suggerirebbe l’esistenza di una possibile associazione anche tra taglio cesareo ed asma ed obesità infantili. Da un punto di vista epidemiologico, in effetti, asma ed obesità infantili sembrano essere maggiormente associati alla nascita mediante taglio cesareo che non a quella per via vaginale (9, 10). Ovviamente questo tipo di affermazioni, perché risultino scientificamente robuste, necessitano di una corretta comparazione dei gruppi e della più stringente eliminazione di tutti i potenziali fattori confondenti. Essendo infatti molte le variabili in gioco capaci di influenzare i “quadri” microbici di un individuo (genitori, fratelli, abitazione, presenza di animali, ecc.), questi studi dovrebbero sempre paragonare due fratelli esclusivamente discordanti per la tipologia di parto ma coincidenti per ogni altro fattore correlabile con la costruzione del proprio microbiota. Il più importante e corposo studio di questo tipo, eseguito su quasi 100 mila soggetti e finalizzato ad osservare una possibile correlazione tra nascita per taglio cesareo e rischio di obesità, ha recentemente concluso che questa associazione non risulta essere statisticamente significativa. A meno che, però, non si eliminino tutte le variabili che in maniera casuale possono contribuire ad influenzare l’assetto microbico di un individuo. Valutando infatti solo i fratelli esclusivamente discordanti per modalità di parto ma assolutamente sovrapponibili per ogni altra variabile, la differenza osservata diventa infatti statisticamente significativa (11). Similmente, lo studio dell’andamento dell’indice di massa corporea in relazione alla tipologia di allattamento, al seno verso artificiale, ha dimostrato come il primo produca, almeno nei primi 5 anni di vita, valori di BMI più bassi (12).
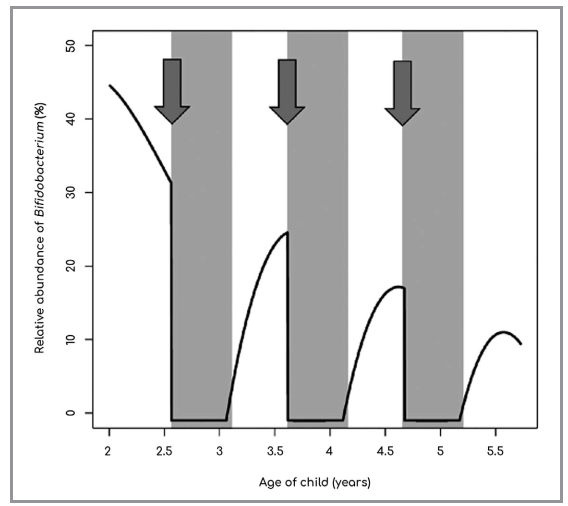
rispetto all’età (in ascissa) in dipendenza della somministrazione di antibiotici
(frecce). Le bande verticali grigie indicano l’aumentata presenza di LPS provocata
dalla riduzione antibiotico-dipendente dei bifidobatteri (Korpela K, de Vos WM.
Antibiotic use in childhood alters the gut microbiota and predisposes to overweight.
Microb Cell 2016; 3 (7): 296-298).
ASPETTI FONDAMENTALI PER IL TRASFERIMENTO VERTICALE MADRE-FIGLIO DI BIFIDOBATTERI
Affinché un’opportuna quantità, e qualità, di bifidobatteri possa effettivamente raggiungere, colonizzare e strutturare un consorzio semipermanente nel neonato, alcuni aspetti devono essere considerati come fondamentali. In primis, la madre deve avere nel proprio consorzio fecale colonico un certo numero di colonie proliferanti di bifidobatteri. La madre è, ovviamente, un adulto e gli adulti purtroppo spesso possono essere invece totalmente privi del genere Bifidobacterium. Questo non deve stupire. I bifidobatteri sono batteri che fisiologicamente si riscontrano quasi esclusivamente nel microbiota fecale colonico dei bambini e un’abbondante presenza nel consorzio dell’adulto si configura solo in seguito a supplementazione. Si potrebbe addirittura speculare dicendo che le colonie fecali coloniche di bifidobatteri esistono nell’adulto nella misura in cui quest’ultimo, se di sesso femminile, dovrà un giorno trasferirli al nascituro perché ostacolino l’altrimenti eccessiva quantità di Proteobacteria. Anche quest’ultima, l’elevata presenza di Proteobacteria nel contesto di un microbiota fecale, è infatti da considerarsi fisiologica solo nel microbiota neonatale. Nell’adulto infatti, percentuali elevate di Proteobacteria si riscontrano solo in condizioni patologiche (infezioni intestinali, colite ulcerosa, Crohn, carcinoma del colon-retto). Tornando al contesto di un microbiota materno, se i bifidobatteri sono assenti, nulla potrà crearli. E quando anche si configuri nell’adulto una presenza fisiologica minima di bifidobatteri, spesso non oltre lo 0,4%, tale valore rischierà di non essere sufficiente ad assicurare il trasferimento al nascituro. Certo è, invece, che i dati osservativi dicono esattamente il contrario; e cioè che il fenomeno del trasferimento di bifidobatteri dalla madre al figlio accade perché il piccolo valore percentuale presente nell’adulto all’inizio delle gravidanza aumenta anche di 10 volte nell’arco del terzo trimestre. Per meglio comprendere tale incremento numerico si deve considerare che tutti i batteri del microbiota di un individuo sono sottoposti a continue spinte proliferative e selezione da parte dei cosiddetti driver. I più importanti tra questi risultano essere il cibo, gli ormoni, i farmaci (eccipienti inclusi), i dolcificanti artificiali e i metaboliti secondari del mondo vegetale (i polifenoli ad esempio). Il progesterone, in questo senso, costituisce sicuramente, almeno in una donna in gravidanza, il driver proliferativo più importante per il genere Bifidobacterium (13). Il ruolo pro-bifidobatteri del progesterone è stato osservato tanto nelle gravidanze del genere umano quanto in quelle degli animali da esperimento, così come anche somministrando per bocca l’ormone in procedure sperimentali in assenza di una condizione gravidica o ancor più semplicemente aggiungendo progesterone al materiale fecale contenuto in una provetta (Fig. 3). È quindi il progesterone a determinare l’aumento del valore percentuale di bifidobatteri nel microbiota materno così da aumentare le possibilità di trasferimento durante il parto, prima, e durante l’allattamento, dopo. Il secondo momento fondamentale coincide quindi con l’azione del progesterone capace di aumentare di alcuni punti percentuali il contenuto fecale colonico di bifidobatteri in una donna incinta. Il terzo momento, fondamentale per la corretta trasmissione dei bifidobatteri, è invece il parto naturale. I bambini nati da taglio cesareo, come anche quelli che hanno subito terapie antibiotiche intra-partum, se non adeguatamente supplementati, mancano, o risultano molto carenti, infatti di bifidobatteri (14). Il parto naturale, grazie alla probabile presenza di bifidobatteri in sede vaginale e alla possibile contaminazione del nascituro con materiale fecale materno, è garante di un primo potenziale trasferimento di bifidobatteri al neonato. Infine, il quarto momento fonda-mentale: l’allattamento. Sicuramente favorito, e talvolta persino innescato, dal parto naturale, il latte materno dimostra importanti differenze con quello artificiale. È infatti ricchissimo di particolari oligosaccaridi, detti appunto “del latte materno”, spesso identificati con l’acronimo inglese HMO e molto simili chimicamente ai glicani della mucina. Questi, sintetizzati a livello mammario da alcune glicosil-transferasi, codificate dai geni Se e Le, aggiungono zuccheri allo scheletro carbonioso del lattosio producendouna serie di composti, circa 200, a capacità prebiotica quasi esclusiva per le sole popolazioni intestinali di bifidobatteri (15). Il latte materno risulta quindi essere un importante veicolo di molecole, insostituibili per forza prebiotica, capaci di permettere l’espansione clonale di quei bifidobatteri che, subito dopo il parto, dovrebbero aver iniziato a colonizzare l’area intestinale del nascituro. Non va poi dimenticata la ricchezza microbiologica del latte materno. Grazie infatti al circolo entero-mammario, le cellule dendritiche materne sono in grado di trasportare i batteri intestinali materni, bifidobatteri inclusi, fino alla ghiandola mammaria, consentendo, grazie alla suzione del latte, un continuo inoculo di bifidobatteri dalla madre al neonato. In considerazione della frequente possibilità che il neonato vada incontro a numerosi cicli di terapia antibiotica nei primi mesi di vita, quest’ultima funzione del latte materno, la veicolazione cioè di batteri materni, appare potenzialmente capace di conservare nel tempo un buon profilo di ricchezza batterica all’interno del microbiota del neonato.
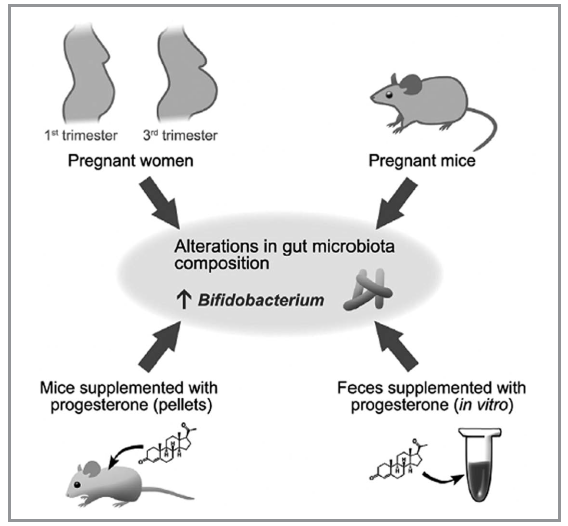
mentando il loro valore percentuale all’interno del consorzio microbico fecale
colonico. Il fenomeno, osservato clinicamente e sperimentalmente, viene riprodotto
anche facendo assumere a topolini non in stato gravidico del progesterone o più
semplicemente aggiungendo del progesterone in una provetta contenete mate-
riale fecale (Nuriel-Ohayon M, Neuman H, Ziv O et al. Progesterone Increases
Bifidobacterium Relative Abundance during Late Pregnancy. Cell Rep 2019; 27
(3): 730-736.e3).
LA COLPA DEI PROTEOBACTERIA
La problematica posta in essere dalla necessità di avere un congruo quantitativo di bifidobatteri nel microbiota del neonato è per gran parte riconducibile, anche se non solo, alla necessità di ostacolare l’altrimenti eccessiva e solitaria dominanza di batteri Gram-negativi come Escherichia, Shigella, Klebsiella, Pseudomonas, Cronobacter, Salmonella, Proteus o Acinetobacter, solo per citarne alcuni. Viene da domandarsi perché invece non concentrarsi sulla loro eliminazione. Il problema è che eliminarli, oltre che essere più facile a dirsi che a farsi, risulterebbe nocivo e impedirebbe la futura costruzione di un microbiota adulto, che dovrebbe essere capace in primis di affrontare lo svezzamento. I Proteobacteria infatti sono in grado di sopravvivere anche in un intestino neonatale ricco di ossigeno. La loro presenza in questa prima fase consuma questo gas, tossico per la maggior parte dei batteri intestinali, riducendone le quantità fino a creare, nel colon, l’anaerobiosi stretta. La loro presenza, in parole semplici, è necessaria ad abbassare l’iniziale ed elevata tensione di ossigeno presente nell’ambiente intestinale del neonato per favorire la successiva sopravvivenza di phylum come Firmicutes e Bacteroidetes, ossigeno-intolleranti, che costituiranno il 95% del microbiota dell’adulto e che sono necessari al bambino per la metabolizzazione delle fibre polisaccaridiche che caratterizzeranno l’alimentazione tipica dello svezzamento (16).
I BIFIDOBATTERI NON SONO TUTTI UGUALI
Come è facile intuire, non tutti i bifidobatteri sono comunque ugual-mente utili. Se tutti, molto probabilmente, rispondono al progesterone aumentando di numero, non tutti sono ad esempio in grado di metabolizzare gli HMO, proliferando di conseguenza. Per metabolizzare gli HMO è necessario avere un adeguato pool enzimatico nel proprio genoma. Metabolizzatori efficienti, cioè capaci anche in forma isolata di aggredire e ridurre a monosaccaridi gli HMO sono soltanto la specie B. bifidum e la sottospecie B. longum infantis (17). Tra i due però solo la specie B. bifidum è in grado di favorire l’intero consorzio microbico attuando, attraverso la messa disposizione dei frammenti derivanti dalla digestione degli HMO, un comportamento non egoistico che consente anche ad altra generi batterici di partecipare al “banchetto”. Questo comportamento favorisce ad esempio B. breve, specie di per sé incapace di metabolizzare gli HMO ma in grado di acquisire tale competenza, almeno in forma parziale, in presenza di B. bifidum (18). Al contrario la sottospecie B. longum infantis, attraverso l’internalizzazione nel proprio corpo cellulare degli stessi HMO, adotta un comportamento egoistico che non favorisce la proliferazione di altri generi batterici. Purtroppo la presenza di B. bifidum nel contesto microbico neonatale non è certamente comune. Rara addirittura è la presenza di B. longum infantis. Molto più comuni sono invece le specie di B. longum, B. adolescentis, B. catenulatum e B. pseudocatenulatum che, però, dimostrano poca, o nulla, capacità di metabolizzazione degli HMO e, almeno in una fase neonatale, possono essere considerati se non inutili, meno utili.
I “BIFIDOTIPI” NEONATALI
Recentemente è stato possibile quantificare la presenza nei consorzi neonatali delle varie specie di Bifidobacterium. Si voleva infatti comprendere quale fosse la reale possibilità che un neonato partorito per via vaginale e allattato al seno potesse ad esempio mostrare un consorzio fecale colonico caratterizzato da una qual certa presenza e dominanza di B. bifidum, condizione questa considerata almeno teoricamente come privilegiata. Classificando i consorzi neonatali in base alla specie di Bifidobacterium dominante, è stato possibile osservare l’esistenza di cinque diversi bifidotipi, chiamati semplicemente A, B1, B2, C e D (19). Nel bifidotipo A la specie dominante è B. bifidum; nel bifidotipo B1 la specie dominante è B. breve, ma vi è comunque una forte presenza anche di B. bifidum e di un consorzio molto complesso e ricco, cosa che rende questo cluster il più biodiverso; nel bifidotipo B2 la specie dominante è ancora B. breve ma in questo caso B. bifidum è scarsamente rilevato; nel bifidotipo C la specie dominante è invece B. longum; infine, nel bifidotipo D, la specie dominante è B. adolescentis. Da un punto di vista percentuale i bifidotipi si presentano rispettivamente nel 10 (tipo A), nel 15 (tipo B1), nel 15 (tipo B2), nel 40 (tipo C) e nel 20% (tipo D) dei casi. La possibile dominanza di B. longum infantis non è invece risultata rilevabile, ed è quindi probabilmente inferiore all’1% dei casi, mentre il consorzio caratterizzato da una forte presenza di B. bifidum si è presentato nel 25% dei casi circa, essendo stato rilevato tanto nel cluster A quanto nel B1 (Fig. 4).
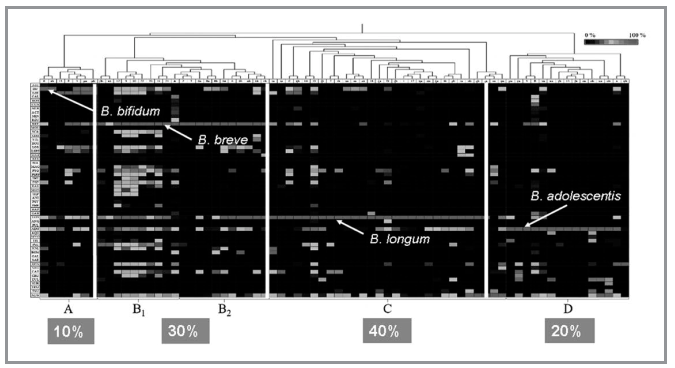
per via vaginale ed allattati al seno (Duranti S, Lugli GA, Milani C et al. Bifido-
bacterium bifidum and the infant gut microbiota: an intriguing case of microbe-host
co-evolution. Environ Microbiol 2019; 21(10): 3683-3695).
LA SCELTA PROBIOTICA
L’aver determinato la necessità di un intestino “bifidobatterico”, almeno nel neonato, con particolare rilevanza per la specie B. bifidum, e l’aver osservato che anche nelle condizioni migliori solo il 25% dei neonati potrebbe esserne dotato, aumenta il livello di conoscenza e consapevolezza ma spinge anche ad interrogarsi sulla correttezza delle scelte probiotiche. Queste ultime sono, tra le opzioni terapeutiche disponibili, sicuramente molto diffuse in ambito medico. I settori nei quali la scelta terapeutica ricade maggiormente su di un probiotico sono sicuramente la ginecologia, la gastroenterologia e la pediatria. Spesso però la scelta di un probiotico da prescrivere non viene fatta rivolgendo tutta la dovuta attenzione agli aspetti di genere e specie che invece sarebbe opportuno fare in relazione al microbiota sul quale si vuole incidere. Non tutti i generi, in quanto probiotici, risultano infatti parimenti utili al fine di costruire un consorzio microbico adatto. E come gli studi eseguiti sul consorzio microbico vaginale hanno stabilito che la scelta più opportuna per rendere stabile tale microbiota sarebbe quella di optare per ceppi di Lactobacillus crispatus (20), i dati attuali indicano che in ambito pediatrico e/o neonatale, almeno quando l’approccio terapeutico è rivolto ad un individuo non ancora completamente svezzato e quindi microbiologicamente parlando, non ancora adulto, l’opzione migliore sarebbe quella di somministrare ceppi ben caratterizzati di B. bifidum (21) Non quindi, come più spesso succede, probiotici del genere Lactobacillus almeno senza averne verificato la reale carenza, o bifidobatteri per i quali è nota l’assenza di quell’impianto genico che ne garantisce gli aspetti di colonizzazione e di dominanza. Non resta che domandarsi se, almeno in linea teorica, il pediatra abbia a disposizione ceppi documentati da poter impiegare in ambito neonatale in base alle ultime ricerche sul microbiota dei “cuccioli” di uomo. Se si opera una ricerca su PubMed il B. bifidum ad oggi più documentato del mondo, e meglio caratterizzato per il suo possibile ruolo neonatale, è sicuramente il ceppo PRL2010 per il quale esistono ampie revisioni pubblicate su riviste estremamente impattanti e scientificamente celebri come, giusto per fare un esempio, PNAS (22).
BIBLIOGRAFIA
1. Bach JF. The Effect of Infections on Susceptibility to Autoimmune and Allergic Diseases. N Engl J Med 2002; 347 (12): 911-20.
2. Turroni F, Milani C, Duranti S, Ferrario C, Lugli GA , Mancabelli L, van Sinderen D, Ventura M. Bifidobacteria and the Infant Gut: An Example of Co-Evolution and Natural Selection. Cell Mol Life Sci 2018; 75 (1): 103-118.
3. Fujimura KE, Sitarik AR, Havstad S, Lin DL, Levan S, Fadrosh S, Panzer RA, LaMere R, Rackaityte E, Lukacs NW, Wegienka G, Boushey HA, Ownby DR, Zoratti E, Levin AM, Johnson CC, Lynch SV. Neonatal Gut Microbiota Associates With Childhood Multisensitized Atopy and T Cell Differentiation. Nat Med 2016; 22 (10): 1187-1191.
4. Turta O, Rautava S. Antibiotics, Obesity and the Link to Microbes – What Are We Doing to Our Children? BMC Med 2016; 14: 57.
5. Korpela K, de Vos WM. Antibiotic use in childhood alters the gut microbiota and predi-sposes to overweight. Microb Cell 2016; 3 (7): 296-298.
6. Korpela K, de Vos WM. Early life colonization of the human gut: microbes matter every-where. Curr Opin Microbiol 2018; 44: 70-78.
7. Khokhlova EV, Smeianov VV, Efimov BA, Kafarskaia LI, Pavlova SI, Shkoporov AN. Anti-inflammatory properties of intestinal Bifidobacterium strains isolated from healthy infants. Microbiol Immunol 2012; 56 (1): 27-39.
8. Gomez-Llorente MA, Romero R, Chueca N, Martinez-Cañavate A, Gomez-Llorente C. Obesity and Asthma: A Missing Link. Int J Mol Sci 2017; 18 (7): 1490.
9. Thavagnanam S, Fleming J, Bromley A, Shields MD, Cardwell CR. A meta-analysis of the association between Caesarean section and childhood asthma. Clin Exp Allergy 2008; 38 (4): 629-33.
10. Yuan C, Gaskins AJ, Blaine AI et al. Association Between Cesarean Birth and Risk of Obesity in Offspring in Childhood, Adolescence, and Early Adulthood. JAMA Pediatr 2016; 170 (11): e162385.
11. Ahlqvist VH, Persson M, Magnusson C, Berglind D. Elective and nonelective cesarean section and obesity among young adult male offspring: A Swedish population-based cohort study. PLoS Med 2019; 16 (12): e1002996.
12. Zheng M, Cameron AJ, Birken CS et al. Early Infant Feeding and BMI Trajectories in the First 5 Years of Life. Obesity (Silver Spring) 2020; 28 (2): 339-346.
13. Nuriel-Ohayon M, Neuman H, Ziv O et al. Progesterone Increases Bifidobacterium Relative Abundance during Late Pregnancy. Cell Rep 2019; 27 (3): 730-736.e3.
14. Korpela K, Salonen A, Vepsäläinen O et al. Probiotic supplementation restores normal microbiota composition and function in antibiotic-treated and in caesarean-born infants. Microbiome 2018; 6 (1): 182.
15. Musilova S, Rada V, Vlkova E, Bunesova V. Beneficial effects of human milk oligosaccharides on gut microbiota. Benef Microbes 2014; 5 (3): 273-283.
16. Miquel S, Leclerc M, Martin R et al. Identification of metabolic signatures linked to anti-inflammatory effects of Faecalibacterium prausnitzii. mBio 2015; 6 (2): e00300-15.
17. Gotoh A, Katoh T, Sakanaka M et al. Sharing of human milk oligosaccharides degradants within bifidobacterial communities in faecal cultures supplemented with Bifidobacterium bifidum. Sci Rep 2018; 8 (1): 13958.
18. Turroni F, Özcan E, Milani C et al. Glycan cross-feeding activities between bifidobacteria under in vitro conditions. Front Microbiol 2015; 6: 1030.
19. Duranti S, Lugli GA, Milani C et al. Bifidobacterium bifidum and the infant gut microbiota: an intriguing case of microbe-host co-evolution. Environ Microbiol 2019; 21 (10): 3683-3695.
20. Di Pierro F, Polzonetti V, Patrone V, Morelli L. Microbiological Assessment of the Quality of Some Commercial Products Marketed as Lactobacillus crispatus-Containing Probiotic Dietary Supplements. Microorganisms 2019; 7 (11): 524.
21. Turroni F, Duranti S, Milani C, Lugli GA, van Sinderen D, Ventura M. Bifidobacterium bifidum: A Key Member of the Early Human Gut Microbiota. Microorganisms 2019; 7 (11): 544.
22. Turroni F, Bottacini F, Foroni E et al. Genome analysis of Bifidobacterium bifidum PRL2010 reveals metabolic pathways for host-derived glycan foraging. Proc Natl Acad Sci USA 2010; 107 (45): 19514-19519.
Per gentile concessione dalla pubblicazione originale: edit Symposia nr. 1 – 2020 – Editeam, Cento